めっきを、前述のとおり
「溶液を用いるなど湿式の工法によって材料の表面に別の金属皮膜を形成すること」
に限定するとしても、正しくこれを用いるには、
3つの方法について確認しておかなければなりません。
- A. 電気めっき
- B. 無電解めっき(置換型、還元型)
- C. 溶融めっき
A. 電気めっき
電気めっきは「電気分解」の一種と言えます。
電気分解は、溶液の中にある化学物質の酸化/還元、
あるいは電極物質の酸化(溶解)/還元(析出)に用いられます。
この現象は3つの場所に分けて考える事ができます。
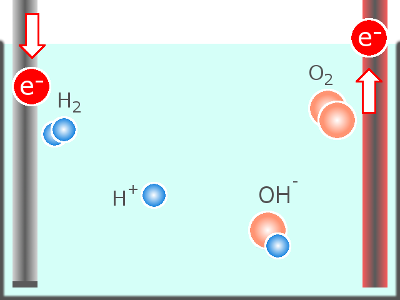
以下、水(H2O)の電気分解を例に整理します。
図では、H2O など説明にあまり関わらない要素は省略します。
[陽極と溶液との間]
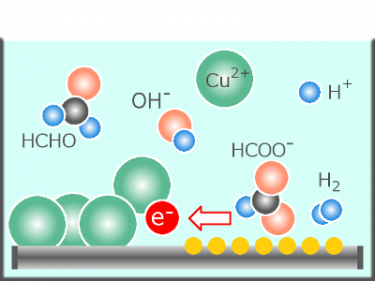
11. 化学物質から電子を奪う(化学物質を酸化する)
12. 陽極材料を溶解する
<水の電気分解では..>
→ OH– から電子を奪い H2O と酸素に変える
→ 減った OH– に応じて H2O が H+ と OH– とに電離する
4OH– → O2+2H2O+4e–
H2O ⇄ H++OH–
電気分解では、電気めっきと違って電極自身が溶けてしまうと困ります。
このため陽極にはイオン化傾向の小さな白金電極や炭素電極を用い、
替わりに OH– が酸化するようにしています。
この電極と溶液との間に加わる電圧が、
[酸化還元電圧+酸素過電圧](*1)
を超えたときに反応は起こります。
[陰極と溶液との間]
21. 化学物質に電子を与える(化学物質を還元する)
22. 化学物質を析出させる
<水の電気分解では..>
→ H+ に電子を与え水素に変える
→ 減った H+に応じて H2O が H+ と OH– とに電離する
2H++2e– → H2
この電極と溶液との間に加わる電圧が、
[酸化還元電圧+水素過電圧](*1)
を超えたときに反応は起こります。
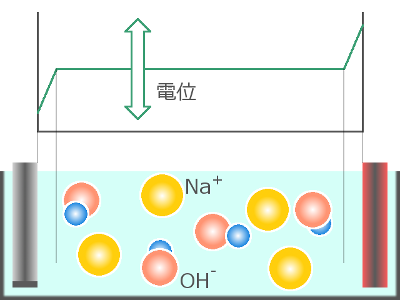
[溶液]
31. 動ける正電荷と負電荷とで溶液を満たす
<水の電気分解では(NaOHを用いる場合)..>
→ Na+と OH– とで溶液を満たす
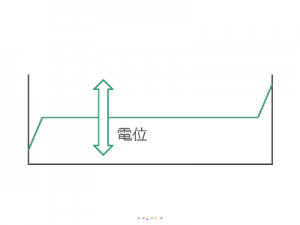
NaOH は、陰極/陽極の反応には直接関係しませんが、動ける電荷で溶液を満たします。
これによって溶液中の電位はほぼ一定となり、電位差を、陽極と溶液との間、
陰極と溶液との間、という電気化学反応に必要な2箇所に
集中させることができます。
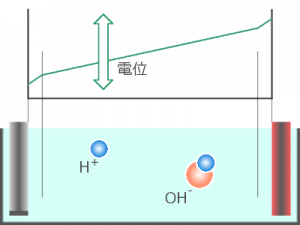
これに対して H2O は電離度が非常に低く( H+ や OH– の濃度が低く)、
溶液が H2O だけの場合、電位差は電極と H2O との間ではなく
ほとんどが H2O 自体にかかってしまいます。
さて、本題は電気めっきです。
前節の銅めっきを例に、上と同じ番号を使って水の電気分解と比べてみましょう。
[陽極と溶液との間]
11. めっき金属から電子を奪う(酸化する)
12. めっき金属を溶解する
<電気銅めっきでは..>
→ めっき金属は銅(Cu)
電気分解と同様に白金電極や炭素電極を陽極に用いた場合、
それは酸化せず(溶け出さず)、したがってめっきに使える銅イオンは、
最初から溶液中に溶けているものだけです。
一方、銅を陽極に用いればそれは酸化し(溶け出し)、充分な銅イオンを
ここから供給することができるようになります。
電気分解の陽極は OH–(または H2O)を酸化しましたが、
電気めっきではその替わりにめっき金属(この場合は銅)を酸化するということです。
[陰極と溶液との間]
21. めっき金属に電子を与える(還元する)
22. 陰極である素地金属の表面にめっき金属を析出させる
<電気銅めっきでは..>
→ めっき金属は銅(Cu)
電気めっきの陰極は素地金属です。
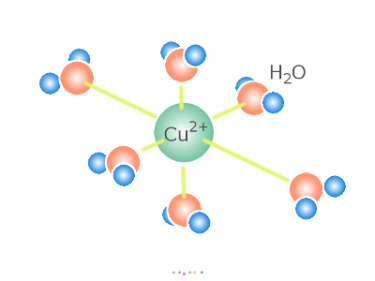
水和した銅イオンは、ここでまず H2O 分子を脱落させ、
陰極から電子を与えられ(還元され)、そして素地金属の表面に析出します。
陰極は、電気分解では H+ を還元しましたが、
電気めっきではその替わりにめっき金属イオン(この場合は銅イオン)を還元することになります。
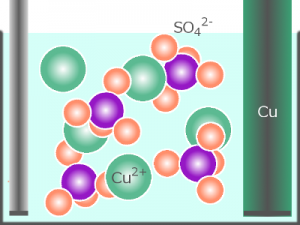
[溶液]
31. 動ける正電荷と負電荷とで溶液を満たす
32. めっき金属イオンを陰極側へ運ぶ
<電気銅めっきでは..>
→ 正電荷は銅イオン、負電荷は硫酸イオン
→ めっき金属イオンは銅イオン
電気分解と同様、電気めっきでも、電解質(硫酸銅)は溶液に
電位差が食われてしまわないように働きます。
電気めっきではそれに加え、めっき金属イオンを陽極から陰極へ運ぶ役割も持っています。
*1)
標準電極電位(=標準酸化還元電位)は、ギブスエネルギーの変化を
電子が感じる電位になおした理論値で、イオン化傾向の大小をそのまま表しています。
酸化還元電位は、その標準電極電位と、還元種や酸化種の濃度とから計算できます(ネルンストの式)。
電気分解やめっきではさらに、水素過電圧、酸素過電圧といった余分な電圧が必要になります。
| 金属 | 標準酸化還元電位 (標準電極電位) | イオン化傾向 |
|---|---|---|
| Li | -3.045 V | 大 |
| K | -2.925 V | |
| Ca | -2.84 V | |
| Na | -2.714 V | |
| Mg | -2.356 V | |
| Al | -1.676 V | |
| Mn | -1.185 V | |
| Zn | -0.762 V | |
| Cr | -0.744 V | |
| Fe | -0.447 V | |
| Cd | -0.403 V | |
| Co | -0.277 V | |
| Ni | -0.257 V | |
| Sn | -0.138 V | |
| Pb | -0.126 V | |
| (H) | 0 V | |
| Cu | +0.34 V | |
| Hg | +0.796 V | |
| Ag | +0.799 V | |
| Pt | +1.188 V | |
| (H2O) | +1.229 V | |
| Au | +1.52 V | 小 |